Ações Farmacológicas
Algumas das ações farmacológicas de Aconitum napellus são (1):
-
Efeitos cardíacos: devido aos alcalóides diterpénicos que possui e os quais atuam nos canais de sódio dependentes da voltagem, podendo apresentar atividade arritmogénica (ex.: aconitina) ou anti-arritmogénica (ex.: lapaconitina), dependendo do mecanismo de ação.
-
Efeitos no sistema nervoso: devido a alguns alcalóides diterpénicos que atuam como antagonistas seletivos nos receptores nicotínicos da acetilcolina ou inibe a repolarização. Pode também apresentar efeitos antiepiléptico ou epileptiforme e efeito analgésico.
-
Efeito anti-microbiano e efeito citotóxico: ambos atribuídos aos alcalóides diterpénicos.
Para conhecer os diferentes efeitos da planta em mais detalhe carregue nos seguintes botões.
 Efeitos Cardíacos |  Efeitos no Sistema Nervoso |  Outros efeitos |
|---|
NOTA INTRODUTÓRIA: CANAIS DE SÓDIO DEPENDENTES DA VOLTAGEM

Figura 1: Diferentes conformações dos canais de sódio dependentes da voltagem. Os diferentes compostos podem atuar na conformação fechada, impedindo ou promovendo a sua abertura; na conformação aberta ou na conformação inativa, prolongando o tempo de inativação e aumentando dessa forma o período de recuperação da célula.
Retirado de: http://cnx.org/contents/a4ca89c4-ab19-492f-a910-8f0f7867999f@1
Tendo em conta que os canais de sódio dependentes da voltagem são alvos de vários alcalóides do acónito e essa ação está na base dos efeitos cardíacos e neuronais é importante conhecer alguns aspetos acerca desse canal iónico.
Este canal iónico possui 3 conformações: quando a célula (neurónio ou células cardíaca) se encontra em repouso o canal está fechado mas disponível para ser ativado. Quando ocorre uma alteração no potencial de membrana da célula, ocorre abertura do canal com entrada de sódio.
Posteriormente, o canal fica na conformação inativa na qual se encontra fechado mas não está disponível para ser novamente ativado até a célula recuperar o potencial de repouso (fase de repolarização). Se a célula não recuperar, fica incapaz de receber nova informação e de despolarizar novamente.
A entrada de sódio na célula é responsável pelo processo de despolarização que no caso dos neurónios é necessário para a condução da informação nervosa e no caso do coração é necessário para haver contração.
Dependendo da estrutura química, os alcalóides existentes nas raízes das várias espécies de acónito podem ser arritmogénicos ou anti-arrítmicos. Em ambos casos, os efeitos a nível cardíaco são devido à atuação nos canais de sódio dependentes da voltagem.
Daqueles que possuem potencial arritmogénico, a aconitina é a mais ativa. Os alcalóides pró-arrítmicos têm uma elevada afinidade para o estado aberto dos canais de sódio e ligam-se no NBS-2 (neurotoxin binding site-2). Após a ligação vão ativar os canais de sódio quando estes estão em repouso e vão impedir a sua inativação.


Os alcalóides com esta capacidade têm um esqueleto similar ao da aconitina. Além disso, o potencial pró-arritmico depende dos substituintes que possuem. Sendo assim, é necessário existir um grupo β-hidroxilo no C13, um grupo α-aroíl no C14, um grupo β-acetato no C8 e um átomo de azoto carregado positivamente. Se houver destruição desse sistema de três substituintes, o composto perde as suas propriedades arritmogénicas.
Figura 2: Estrutura dos canais de sódio dependentes de voltagem e locais de ligação de diferentes toxinas com destaque para o local de ligação 2 onde se ligam os alcalóide pro-arritmogénicos de Aconitum spp.
Imagem adaptada de http://journal.frontiersin.org/article/10.3389/fphar.2011.00071/full
Figura 3: Estrutura química da aconitina, o alcalóide com maior potencial arritmogénico. A verde estão rodeados os sistemas de substituintes que são essenciais para haver atividade arritmogénica.
Imagem adaptada de: http://commons.wikimedia.org/wiki/File:Aconitine_new.png
Relativamente aos compostos com potencial anti-arrítmico, já foi feito um estudo farmacológico extenso acerca dos alcalóides de acónito e isso permitiu a criação de um novo grupo de fármacos anti-arritmicos.
Esse grupo inclui alcalóides tais como a lapaconitina, N-desacetil-lapaconitina, 6-benzoil-heteratisina e GFA (Guanfu base A). Verifica-se que o ED50 (dose necessária para ter um efeito de 50%) e a janela terapêutica destes compostos são similares ou melhores do que os de alguns compostos antiarrítmicos já usados na medicina (procainamida e etmozina).
A alapinina é um fármaco anti-arritmico da classe Ic descoberto nos anos 80 e corresponde ao hidrobrometo de lapaconitina. É especialmente eficaz na prevenção de fibrilhação auricular paroxística e está à venda na Rússia. Entretanto, já se tentou criar métodos de obtenção de lapaconintina e formar complexos com esta de forma a aumentar a ação terapêutica.
A GFA e a 6-benzoil-heteratisina mostraram ser potentes anti-arritmicos com baixa toxicidade em animais, pelo que atualmente estão em ensaios clínicos.
Os alcalóides do acónito antiarritmicos podem atuar de duas formas: inibir os canais de sódio dependentes da voltagem (funcionam como antagonistas competitivos em relação aos alcalóides de acónito pro-arritmogénicos) e/ou bloqueio da corrente de potássio de repolarização. Pensa-se que apenas exercem os seus efeitos em células com uma grande frequência de potenciais de ação, que é o que ocorre durante as arritmias (isto terá vantagens a nível de especificidade, visto que, se apenas bloqueiam células hiperexcitáveis, não irão afetar as células normais, bloqueando apenas a actividade das células arrítmicas).
A lapaconitina por exemplo, bloqueia irreversivelmente os canais de sódio dependentes da voltagem no coração. Em ensaios com coração isolado de cobaias, verificou-se que tanto a lapaconitina como a N-desacetil-lapaconitina diminuem a frequência cardíaca e possuem um efeito inotrópico negativo (efeito dependente da dose). Isto é especialmente curioso visto que, a lapaconitina é um análogo estrutural da aconitina e esta última por sua vez é um potente arrítmogénico.

Figura 4: Mecanismo de ação de alcalóides do acónito antiarrítmico (bloqueio dos canais de sódio dependentes da voltagem).
Imagem adaptada de: https://dundeemedstudentnotes.wordpress.com/2012/04/06/action-potentials/
Os alcalóides antiarrítmicos têm alguns elementos estruturais em comum: presença de resíduo de ácido antranílico ou acetilantranílico no C4, grupos metoxi no C1, C14, C16 e grupo OH no C8.
-
Os alcalóides antiarrítmicos mais potentes são de facto análogos da aconitina possuindo um éster aromático no C1, C6 ou C14 e um átomo de azoto carregado positivamente. A não existência de substituinte na posição C7 não parece ser importante para o composto ter atividade antiarrítmica.

Figura 4: Estrutura quimica da aconitina (alcalóide arritmogénico), da lapaconitina e da N-desacetilapaconitina (antiarritmicos). A verde estão assinalados os elementos estruturais caraterísticos dos compostos antiarritmicos.
Imagem adaptada de: http://www.sciencedirect.com/science/article/pii/S0006295297005455
-
Alcalóides com um grupo benzoílo no C14 são antiarrítmicos altamente potentes. Foi recentemente postulado que a 14-benzoiltalatisamina é um bloqueador seletivo dos canais de potássio responsáveis pela corrente tardia de repolarização.
-
Alcalóides com um éster aromático como substituinte no C1 ou C6 tem uma menor atividade antiarrítmica em comparação com aqueles que têm um éster não aromático. No entanto, entre os alcalóides do tipo heteratisina, os mais ativos são aqueles que têm um resíduo aromático no C6 (6-benzoilheteratisina tem um atividade similar à da lapoaconitina).
-
Compostos do tipo napelina tem uma atividade antiarrítmica pronunciada. A napelina, a songorina e os seus derivados 1-benzoil são os mais ativos. A existência de grupos hidroxilo livres nestes compostos é essencial para a sua ação antiarrítmica; se ocorrer inserção de grupo benzoílo nos grupos hidroxilo do C1, C12 e C15 há perda de atividade.
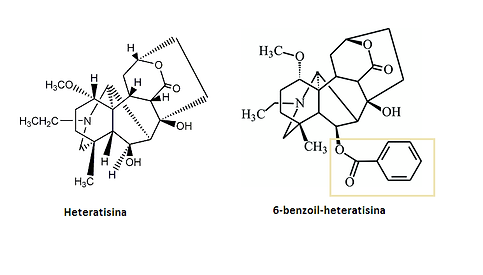
Figura 5: Estrutura quimica da heteratisina e da 6-benzoi-heteratisina (esta última é das que tem potencial anti-arrítmico mais elevado dentro da classe, apesar de ter um potencial inferior aos compostos com estrutura do tipo aconitina).
Imagens retirades de: http://kanaya.naist.jp/knapsack_jsp/information.jsp?word=C00001642 e http://journals.iucr.org/e/issues/2009/07/00/zl2222/zl2222sup0.html
Efeitos a Nível do Sistema Nervoso Central (1)
A nível do sistema nervoso central os alcalóides de acónito têm três principais efeitos: efeito analgésico, efeito antiepilético e ação sobre recetores nicotínicos colinérgicos.
O efeito analgésico ocorre por ativação dos canais de sódio dependentes da voltagem levando a uma despolarização permanente dos neurónios e consequentemente a um bloqueio da condução nervosa que seria responsável pela dor.
.
Há vários estudos em animais que comprovam a eficácia analgésica tanto de extractos de várias espécies de acónito como dos compostos isolados, sendo que esse efeito tanto ocorre a nível do sistema nervoso central como a nível do sistema nervoso periférico. Apesar da eficácia analgésica do acónito ser inquestionável, a verdade é que a janela terapêutica é muito estreita. Os produtos processados à base de acónito têm menos risco de toxicidade mas são também menos eficazes, por isso a relação risco-benefício continua a ser desvantajosa.

Figura 6.
O efeito anti-epilético ocorre por bloqueio dos canais de sódio dependentes da voltagem. Sabe-se que estes canais estão envolvidos na génese de ataques epilépticos. Estudos feitos em hipocampo de rato mostram que alguns alcalóides de acónito bloqueiam os canais de sódio apenas em zonas em que há uma elevada frequência de disparo dos neurónios. Isto é especialmente animador visto que dessa forma é possível bloquear apenas a actividade dos neurónios anómalos que estão envolvidos no ataque epiléptico sem interferir com a actividade normal de outros neurónios.
-
Os alcalóides com maior atividade antiepiléptica são aqueles que tem um substituinte aromático, dos quais se destacam: 6-benzoilheteratisamina, 1-benzoilnapelina, lapaconitina e 14-benzoiltalatisamina. Estes compostos, como referido anteriormente, bloqueiam os canais de sódio; no entanto também se verifica que alguns alcalóides que ativam os canais de sódio têm actividade antiepiléptica: a aconitina e a 3-acetilaconitina suprimem completamente a actividade neuronal epiléptica bem como a atividade neuronal normal, após um estado de hiperexcitabilidade transiente.
-
-
A songorina por outro lado aumenta a excitabilidade dos neurónios a nível do hipocampo de rato. Foi postulado que este efeito advém do fato de ser agonista dos receptores D2. No entanto, estudos mais recentes indicam que a songorina inibe não competitivamente os receptores GABA num local diferente ao qual se liga o substrato endógeno. Sendo assim, este tipo de composto que antagoniza os receptores GABA pode ser útil em investigações que visam procurar ou estudar agonistas GABA.

Figura 7: Estrutura química da songorina
Retirado de: http://www.apexbt.com/nature-products.html
Ação nos recetores colinérgicos nicotínicos (nAChRs)
Há vários tipos de recetores colinérgicos nicotínicos, sendo todos eles constituídos por 5 subunidades. Temos os recetores musculares [(α1)2β1δε] os recetores ganglionares [(α3)2(β4)3] e os recetores a nível do sistema nervoso central que podem ser heteroméricos [(α4)2(β2)3 ou (α3)2(β4)3] ou homoméricos [(α7)5]. (2) A α-bungarotoxina é antagonista competitivo e irreversível dos receptores do tipo muscular e do tipo (α7)5.
A metil-licaconitina bloqueia de forma reversível a ligação da [125I]-α-bungarotoxina, ou seja liga-se ao mesmo sítio que esta e da mesma forma inibe competitivamente a ativação dos canais nicotínicos por parte do seu ligando natural, a acetilcolina. É o antagonista dos recetores nicotínicos do tipo α7 mais selectivo que se conhece. Verifica-se que se liga preferencialmente a recetores neuronais em detrimento de recetores no músculo.
,
Isto é particularmente útil, visto que os receptores nicotínicos colinérgicos são alvos no desenvolvimento de fármacos para tratamento de disfunções cognitivas, depressão, ansiedade, terapia de cessação tabágica e para o síndrome do intestino irritável. Os ligandos dos receptores nicotínicos colinérgicos que sejam seletivos para o sistema nervoso central podem ser úteis não só na pesquisa de novos fármacos, mas também para o estudo da fisiologia dos receptores colinérgicos. Ao contrário da α-bungarotoxina, a metil-licaconitina é uma molécula pequena que consegue passar a barreira hemato-encefálica sendo por isso útil na investigação em neurobiologia.

Figura 8: Estrutura química da metil-licaconitina
Imagem retirada de: http://upload.wikimedia.org/wikipedia/commons/thumb/7/70/Methyllycaconitine.png/220px-Methyllycaconitine.png

Figura 9: Representação esquemática dos diferentes tipos de recetores nicotínicos colinérgicos com as suas subunidades, com indicação dos locais de ligação da acetilcolina.
Retirada de http://www.jbc.org/content/271/30/17656/F1.expansion

Figura 10: Recetor nicotínico colinérgico com as suas subunidades (em cima). Os asteriscos representam os locais onde ocorre ligação da acetilcolina bem como antagonistas colinérgicos, tais como as neurotoxinas e as conotoxinas.
Em baixo tem uma representação do recetor homomérico e heteromérico, sendo que os locais prováveis de ligação da acetilcolina e dos antagonistas são marcados com uma bola preta.
Outros Efeitos (1)
Existem alguns estudos que visam avaliar a atividade antimicrobiana e o potencial anti-tumoral de compostos isolados a partir das raízes de acónito. São no entanto estudos experimentais ainda só efectuados in vitro.
Efeitos antimicrobianos:
-
Testaram-se 33 alcalóides diterpénicos do tipo atisina quanto à atividade antiparasitária contra Leishmania spp. e verificou-se que três dos compostos eram eficazes a inibir o crescimento de L.infantum sem exercer toxicidade para as células do hospedeiro.
-
Testou-se ainda 64 alcalóides quanto ao potencial de inibir o crescimento de Trypanossoma cruzi e dois deles foram eficazes em inibir o crescimento de epimastigotas sem toxicidade para as células hospedeiras.
Efeitos citotóxicos:
-
Inicialmente testou-se o efeito citotóxico de alguns alcalóides para verificar o seu potencial como repelente de insectos. Um dos compostos testados (13-oxocardiopetamina) foi citotóxico para células de mamíferos.
-
Frações do extracto da raiz de Aconitum karakolicum, uma planta tradicionalmente usada como anticancerígeno no Quirguistão, mostraram efeitos antiproliferativos em linhas celulares de células tumorais.
-
Foi feito um estudo que avaliou o potencial citotóxico de 43 alcalóides diterpénicos em várias linhagens celulares e 12 deles exibiram citotoxicidade selectiva para células cancerígenas.
REFERÊNCIAS
1. Nyirimigabo E, Xu Y, Li Y, Wang Y, Agyemang K, Zhang Y. A review on phytochemistry, pharmacology and toxicology studies of Aconitum. J Pharm Pharmacol. 2015;67(1):1-19.
2. http://en.wikipedia.org/wiki/Nicotinic_acetylcholine_receptor (Acesso a 05-06-2015)


